|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В настоящее время установлено, что показатель сердечно-сосудистого риска начинает возрастать при более низких значениях ИМТ (25 кг/м2). В соответствии с этим значение ИМТ в диапазоне 25,0-29,9 кг/м2 было предложено рассматривать, как «избыточную массу тела». В настоящее время изучение нейробиологии ожирения показало: улиц, страдающих ожирением, активность симпатической нервной системы в кровеносных сосудах почек и скелетной мускулатуры увеличена, что подтверждает нейрогенный характер АГ при ожирении. Активация симпато-адреналовой системы при избыточной массе тела в основном является следствием ИР результатом уменьшения плотности инсулиновых рецепторов на увеличенных в размерах и количественно адипоцитах. Повышение тонуса симпато-адреналовой системы сопровождается активацией РААС, что суммарно ведет к повышению АД. ИР характеризуется отсутствием ночного снижения АД («Non-Dipper»), что также клинически подтверждает патологическое повышение симпатического тонуса при висцеральном ожирении. Симпато-адреналовая система (САС), которая имеет сложную систему организации, состоит из центрального отдела (гипоталамус, ретикулярная формация ствола головного мозга), периферических симпатических ганглиев и мозгового слоя надпочечников. Метаболические изменения, наблюдающиеся при ожирении (ИР и компенсаторной гипериинсулинемии - ГИ, селективная лептинорезистентность и гиперлептинемия). вызывают увеличение активности симпатической нервной системы, усиление сосудистого тонуса, повышение общего периферического сопротивления и повышение АД. Исходя из вышеизложенного коррекция ИР, как ведущего фактора в симпатикотонии при ожирении, является важным компонентом в общей схеме лечения АГ. Метфогамма (Верфаг Фарма, Германия) - препарат метформина, группы бигуанидов, стимулирует чувствительность клеточных рецепторов инсулинозависимых периферических тканей и органов (печень, скелетная мускулатура, жировая ткань) к эндогенному инсулину, не оказывая влияния на активность β-клеток поджелудочной железы. Первичный, суммарный гипогликемический эффект Метфогаммы (метформин), в дозе 1000-2000 мг в сутки, вызван снижением продукции глюкозы печенью и свободных жирных кислот (СЖК), через подавление окисления жира, с усилением периферического захвата глюкозы. Гипогликемическая реакция печени на Метфогамму (метформин) обусловлена в первую очередь подавлением процессов глюконеогенеза и в меньшей степени - гликогенолиза, что в конечном итоге манифистируется гликемией натощак. Подобный метаболический эффект Метфогаммы (метформина) на уровне печени обусловлен ингибированием поступления в гепатоциты предшественников глюкозы (лактат, пируват, аминокислота) и ключевых ферментов глюконеогенеза (глюкоза-6-фосфат, фруктоза-1,6-биофосфатаза, пируваткарбоксилаза). Восстановление чувствительности периферической ткани к инсулину под действием препарата Метфогамма (метформин) реализуется через ряд клеточных механизмов: увеличивается количество аффинных к инсулину рецепторов, через стимуляцию тирозинкиназы повышается активность инсулиновых рецепторов, активизируются экспрессия и перемещения из внутриклеточного пула на клеточную мембрану транспортеров глюкозы (ГЛЮТ 1-5). Вышеперечисленные процессы приводят к увеличению поглощения глюкозы органами-мишенями инсулина - печенью, скелетной мускулатурой, жировой тканью. Другими механизмами действия Метфогаммы (метформина) являются снижение гастроинтестинальной абсорбции глюкозы с повышением анаэробного гликолиза, что сопровождается снижением уровня глюкозы в крови, оттекающей от кишечника, с одновременным снижением содержания инсулина (тощаковая инсулинемия) в сыворотке крови, что суммарно приводит к снижению постпрандиальной гликемии. С учетом указанных механизмов действия препарата Метфогамма (метформин) правильнее говорить не о его гипогликемическом, а об антигипергликемическом влиянии [2,3,9,12]. Агонисты I1-имидазолиновых рецепторов (моксонидин) занимают особое место в терапии АГ, сочетающейся с ожирением, через подавление центральной гиперсимпатикотонии. Эти препараты за счет активации имидазолиновых рецепторов I типа в среднем мозге и пресинаптических а-адренорецепторов, уменьшают центральную симпатическую импульсацию, способствуют снижению гидролиза жиров, уменьшению СЖК, усилению метаболизма глюкозы и повышению чувствительности к инсулину, снижению уровня ТГ. повышению ЛПВП и снижению уровня ИАП-1. В исследованиях Н. Lithell (1999 г.) получены данные о влиянии моксонидина на уменьшение ИР. В пилотном исследовании В.А. Алмазова (2000 г.) также подтверждено влияние моксонидина на ИР. Данные исследования подтвердили способность моксонидина влиять на ИР у пациентов с избыточным весом и с НТГ. В сравнительном исследовании ALMAZ была проведена оценка влияния моксонидина и метформина на гликемический контроль у пациентов с избыточным весом, мягкой АГ, ИР и НТГ. Критериями включения пациентов в исследование были: возраст > 40 лет ИМТ > 27 кг/м2, глюкоза натощак >6,1 ммоль/л. Исследование ALMAZ показало, что моксонидин понижал уровень глюкозы натощак, снижал вес пациентов, повышал скорость утилизации глюкозы, снижал ИР. На фоне моксонидина уровень глюкозы натощак снижался менее выражено, чем на фоне метформина, но достоверно снижался уровень инсулина, в то время как метформин на него не влиял, а ИМТ снижался равнозначно на фоне обоих препаратов.[3,4,5]. Оба препарата статистически достоверно повышают чувствительность к инсулину после нагрузки глюкозой. Моксонидин оказывает влияние на уровень инсулина в крови, метформин регулирует уровень глюкозы, что сопровождается снижением гликозилированного гемоглобина. Оба препарата статистически достоверно снижали массу тела, оставаясь метаболически нейтральными к липидам [5,12]. Материалы, методы исследования и лечения Среди 97 пациентов с АГ I-II степени, отобранных для клинического обследования и лечения, было 59 мужчин и 38 женщин в возрасте от 25 до 60 лет (средний возраст по группе составил 51,4±3,5 года). Критериями включения пациентов в программу исследование являлись данные физикального и лабораторного исследования крови: АД>140/90 мм рт.ст.. ИМТ>25 кг/м2, окружность талии для мужчин более 94 см, у женщин - более 80 см, уровень глюкозы в плазме >5,6 ммоль/л. ТГ>1,7 ммоль/л, ХС ЛПВП <1,0 ммоль/л. Всем отобранным в программу исследования больным до и после лечения, с целью оценки степени активности САС. дополнительно к стандартному исследованию биохимических показателей крови (уровень гликемии, гликозилированный НbА1с, липидный спектр крови) проводился двойной динамичный тест (ДДТ) на катехоламины (дофамин, норадреналин, адреналин). В ходе ДДТ анализ крови на гормоны стресса проводится в два этапа: до и после стресса, где в качестве кратковременного стрессорного воздействия использовалось 60-180-секундное пребывание в криосауне. У всех отобранных больных до и после лечения проводили исследование лептина крови методом иммуноферментного анализа с хромогенным субстратом тетраметилбензидином с использованием LEPTIN ELISA (Diagnostics Biochem Canada Inc.). Референтные значения лептина - 2,0-5,6 Нг/мл. В целом по группе отобранных больных для клинического обследования и лечения ИМТ в среднем составил 32,2±1,8 кг/м2. По исходным демографическим, антропометрическим данным, уровням САД и ДАД подгруппы мужчин и женщин с АГ статистически достоверно не различались между собой. В качестве контрольной группы было обследовано 15 нормотоников (АД < 139/89 мм рт.ст.): 9 мужчин и 6 женщин в возрасте от 40 до 55 лет (средний возраст - 49,4±3,3 года). В зависимости от уровня активности центральной САС по динамике стресс-гормонов (дофамин, норадреналин, адреналин) при ДДТ, превышающих 5% исходные величины, пациенты, включенные в программу исследования, были распределены на: подгруппу А - 41 пациент (средний возраст 51,9±2,8 года) - динамика стресс-гормонов при ДДТ > 5% от исходной величины и подгруппу Б - 56 пациентов -динамика стресс-гормонов при ДДТ <5% от исходной величины. Исследуемые подгруппы больных АГ с ожирением (А и Б) статистически не различались между собой по длительности анамнеза АГ, исходным клиническим, антропометрическим и демографическим параметрам (табл. 2). Таблица 2. Клиническая характеристика обследованных групп пациентов
Определение индекса HOMO IR обследованных больных проводилось по методу НОМА (HОmeostasis Model Assessment), предложенному D.M. Matthews и соавт. (1985 г.). HOMO IR = гликемия натощак (ммоль/л) х ИРИ (мкЕД/мл)/22,5 [2]. HOMO IR>2,77. свидетельствует об инсулинрезистентности. В таблице 3 представлены результаты обследования до и после лечения (8 недель) по подгруппам в зависимости от программы лечения: подгруппа А - базовая гипотензивная терапия Моксогамма - средняя по подгруппе суточная доза 0,74±0,03 мг; подгруппа Б - базовая терапия Метфогамма, средняя суточная доза -1825,7±11,7 мг. Таблица 3. Динамика показателей углеводного и липидного спектров крови, инсулинорезистентности до и после лечения в зависимости от программы
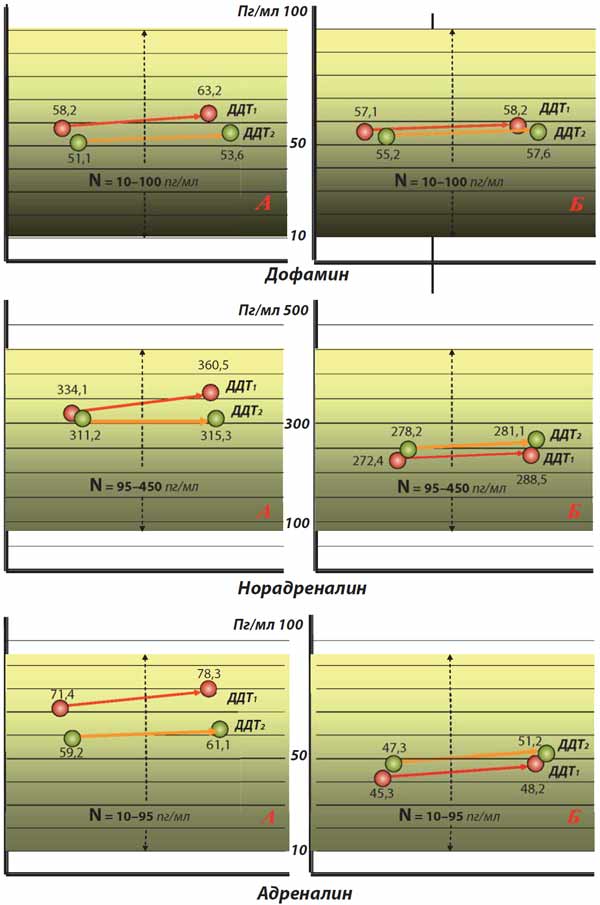
К концу лечения в подгруппе А САД и ДАД снизились статистически достоверно соответственно на 13% и 14,2% (р<0,01) в подгруппе Б аналогичные показатели гемодинамики снизились соответственно на 12% и 12,9%(р<0,05). На фоне статистически достоверного снижения ИМТ на 9,5% (от 32,8±1,1 до 29,7±1,3 кг/м2, р<0,05) в подгруппе А к концу лечения отмечено снижение концентрации лептина в сыворотке крови на 37,4% (р<0,001), в то время как в подгруппе Б аналогичные показатели снизились соответственно на 7,9 и 22,3% (р<0,05). Аналогичная более выраженная, статистически достоверная динамика прослеживается при анализе уровней катехоламинов в подгруппе А: уровень дофамина к концу лечения снизился на 12,2%, норадреналина -на 6,9%, адреналина - на 17,1 % (р<0,05), в то время как в подгруппе Б имело место статистически недостоверное увеличение содержания норадреналина на 2,1% и адреналина - на 4,4% (р>0,05). На рисунке 2 представлена динамика показателей ДДТ после проведенного лечения: в подгруппе А (Моксогамма) динамика ДДТ указывает на снижение активности САС, что документировалось практическим отсутствием нарастания уровней нейрогормонов, в то время как в подгруппе Б (Метфогамма) этот прирост сохранялся. Рис. 2. Динамика гормонов стресса по данным ДДТ до и после лечения по подгруппам больных АГ с ожирением
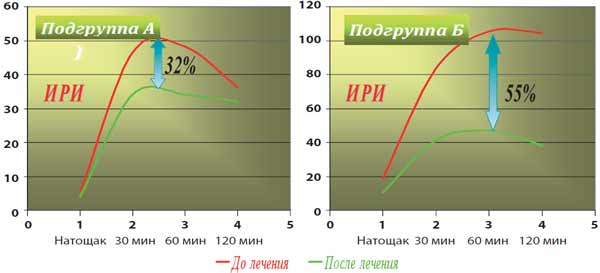
Суммарно снижение активности САС, нормализация ИР, гликемического и липидного спектров крови способствовали достижению целевого уровня давления, со статистически достоверным (р<0,01) снижением в целом по группе к концу 8-й недели наблюдений САД на 14,9% (от 155,3±4,1 до 132,1 ±4,5 мм рт.ст.) и ДАД на 13,6% (от 97,3±3,9 до 84,1±3,5 мм рт.ст). После проведенного лечения (в конце исследования, через 8 недель) в подгруппах А и Б отмечено снижение ИР, что суммарно (в целом по группе) документируется уменьшением площади под кривой ИРИ на 35%. р<0,001 при проведении ПТТГ (р<0,01) (рис. 3). Рис. 3. Диаграмма динамики ИРИ до и после лечения в исследуемых подгруппах А и Б
На фоне снижения ИР у больных АГ, сочетающейся с ожирением и НТГ, отмечены положительные сдвиги в углеводном обмене, что сопровождается снижением уровня НbА1с в подгруппе Б на 6,9% (от 7,42±0,3 до 6,91 ±0,2%, р<0,05), соответственно в подгруппе А аналогичный показатель статистически достоверно уменьшился на 6,4% (от 7,17±0,3 до 6,71 ±0,21 %, р>0,05). Положительные сдвиги после проведенного лечения со стороны эндокринного контроля гликемического профиля, способствовали смещению липидного спектра крови в сторону антиатерогенности: ТГ и ИА снизились соответственно в подгруппе А на 15,4 и 13,5%, в подгруппе Б - на 22,4 и 15,4%; ХС ЛПВП соответственно увеличился на 9,5% и 14,3% (разница статистически достоверна, р<0,01). Обсуждение результатов В последние годы получены новые данные о механизмах ИР и ее роли в развитии многочисленных гормонально-метаболических нарушений, характерных для АГ в сочетании с ожирением и НТГ. Установлено - чувствительность тканей к инсулину снижается более чем на 40% при превышении идеального веса на 35-45%, преимущественно за счет висцерально-абдоминального типа ожирения. ИР может быть как приобретенной, так и генетически детерминированной. Изучение генетических факторов показало, что ИР - это полигенная патология, для развития которой могут иметь значение мутации генов субстратов инсулинового рецептора (IRS-1, IRS-2). 3-адренорецепторов в адипоцитах, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (внутриклеточные транспортеры глюкозы - ГЛЮТ 1-5), белков, связывающих жирные кислоты (FABP-II). Доминирующим направлением фармакотерапии АГ ассоциированной с ожирением, является коррекция ИР -ключевого звена НТГ. В настоящее время одними из препаратов первого выбора фармакотерапии НТГ при ожирении и АГ являются моксонидин (Моксогамма) и метформин (Метфогамма). Согласно рекомендациям Международной Федерации диабета (2005) метформин рекомендуется в качестве антигипертензивной терапии первого ряда для пациентов с СД 2 типа. В крупнейшем исследовании DPP (Diabetes Prevention Program - 2002) было показано, что терапия метформином может эффективно и безопасно предотвращать развитие СД 2 типа у пациентов с НТГ, особенно у пациентов с ИМТ >25 кг/м2. Помимо повышения чувствительности к инсулину скелетной мышечной и жировой ткани, Метфогамма (метформин) замедляет процессы всасывания углеводов в ЖКТ - на уровне продолговатого мозга оказывает анорексигенный эффект. Есть предположение, что метформин реализует анорексигенный эффект через метаболизм глюкогоноподобного пептида-1 (ГПП-1). Метфогамма (метформин) на уровне гипоталамических нейронов модулирует экспрессию орексигенного нейропептида Y что сопровождается снижением массы тела. По данным ряда клиницистов, количество висцерального жира снижается до 15,5% при приеме метформина. Опубликованные данные по применению метформина у подростков с ожирением в течение 6 месяцев показали, что применение метформина сопровождалось снижением ИМТ, объема талии, количества висцеральной жировой ткани, уровня инсулина натощак [4,9,13]. По данным ряда клинических иследований, включение Метфогамму в программу лечения пациентов с ожирением и ИР способствует снижению концентрации ТГ на 10-20%, ХС ЛПНП -на 10% и, как следствие - снижению печеночного синтеза ХС ЛПОНП с повышением его клиренса; одновременно происходит повышение концентрации ХС ЛПВП, суммарно ИА снижается на 10-20%. Все эти эффекты метформина реализуются через повышение чувствительности к инсулину (снижение ИР): снижение поступления в воротную печень СЖК и снижение синтеза ТГ, уменьшаются явления гепато-стеатоза- одного из компонентов МС [12]. Моксогамма (моксонидин) и Метфогамма (метформин) у пациентов с ожирением, ассоциированным с АГ. проявляют кардиоваскулярные протективные эффекты, оказывая положительное влияние на систему гемостаза и реологию крови, способствуют снижению риска тромбообразования через подавление агрегационной активности тромбоцитов. Они опосредованно оказывают антиоксидантное действие на тромбоциты, снижают уровень тромбоцитарного фактора 4 и β-тромбоглобулина, являющихся маркерами активности тромбоцитов [7,13]. Таким образом, данные литературы и наши исследования указывают на выраженную гетерогенность патогенеза АГ у больных с ожирением. Формирование высоких цифр АД обусловлено не только повышением объема циркулирующей крови, адекватно увеличению массы тела, но и метаболическими сдвигами со стороны гликемического и липидного спектров крови, имеющих место при ожирении, ведущих к развитию ИР и компенсаторной гиперинсулинемии с активацией САС. Включение препаратов Метфогамма и Моксогамма. ингибирующих активность САС и повышающих чувствительность инсулиновых рецепторов к инсулину, в программу лечения пациентов с артериальной гипертонией, ассоциированной с ожирением, способствует более эффективному снижению ИР, лежащей в основе метаболических нарушений, нормализации гликемического. липидного профилей, что суммарно ведет к нормализации АД, профилактике атеросклероза и сердечно-сосудистых осложнений. ЛИТЕРАТУРА Факторы риска ССЗ, артериальная гипертония, давление, диабет, ожирение,артериальная гипертония, метаболический синдром, сахарный диабет, состав тела, тощая масса, биоимпедансметрия,инфаркт миокарда, ишемическая болезнь сердца, атеросклероз, гипертоническая болезнь
|
|
|
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Частичная или полная перепечатка материалов сайта возможна только с разрешения администрации сайта:+7 495 225-25-79
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



 Аппарат для объемной сфигмографии: ABI – system 100
Аппарат для объемной сфигмографии: ABI – system 100

 Наркозно-дыхательный
Наркозно-дыхательный
 Анализатор химико-токсикологический IK 200609
Анализатор химико-токсикологический IK 200609