 LogicScan: специализированная УЗИ система для ангиологического скрининга
LogicScan: специализированная УЗИ система для ангиологического скрининга О.Н. Ковалева, А.В. Демиденко, Харьковский национальный медицинский университет
Ремоделирование сердечно-сосудистой системы является неизменным атрибутом артериальной гипертензии (АГ), являясь, с одной стороны, осложнением, с другой – фактором ее прогрессирования. Ремоделирование сосудов – это важный механизм, ответственный за процессы увеличения сосудистого резерва, ауторегуляции церебрального кровотока и развития атеросклероза [1].
|
|
|---|
 LogicScan: специализированная УЗИ система для ангиологического скрининга LogicScan: специализированная УЗИ система для ангиологического скрининга |
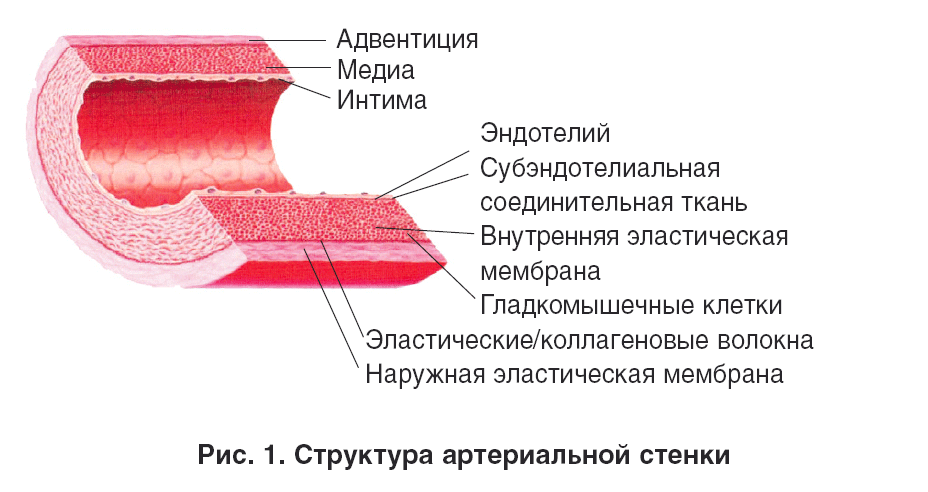
Как известно, артериальная стенка состоит из соединительнотканных структур, разделяющихся на три слоя (рис. 1).
Tunica intima (интима) – внутренняя оболочка. Является барьером между артериальной стенкой и кровью, состоит из одного слоя эндотелиальных клеток, тонкого субэндотелиального слоя и базальной мембраны [1, 2]. Поверхность здорового эндотелия обладает антитромбогенными и антиадгезивными свойствами. Этот клеточный слой функционирует как полупроницаемая мембрана, синтезируя и секретируя ряд регуляторных соединений, обеспечивающих нормальное состояние других сосудистых тканей.
Tunica media (медиа) – средняя оболочка, состоящая из относительно большого количества гладкомышечных клеток (ГМК) и миофибробластов, связанных с соединительной тканью, которая содержит эластические волокна и коллаген. Это наиболее широкий слой артериальной стенки. Его сокращение и расслабление изменяют просвет сосуда в ответ на действие различных системных и локальных вазоактивных соединений, регулирующих сосудистый тонус, скорость кровотока и кровяное давление. Основными эффекторами этой функции сосудистой стенки являются некоторые простагландины, эндотелин и оксид азота [3].
Tunica adventitia (адвентиция) – внешняя оболочка, состоящая из соединительной ткани, содержащей волокна, ГМК, фибробласты, мелкие артерии и вены, связанные с периадвентицией и жировой тканью, поддерживающей сосуд.
Сосуды большого калибра эластического типа – аорта, проксимальный отдел аортальных коллатералей и легочная артерия – сдерживают давление тока крови, но не обладают функцией сократимости. Интима сосудов относительно широкая и покрывает соединительную ткань, богатую коллагеном и эластическими волокнами и содержащую популяцию ГМК. Медиа состоит из концентрически свернутых эластических волокон, которые соединяются между собой небольшими веточками эластина и всего несколькими коллагеновыми волокнами. Адвентиция состоит из рыхлой соединительной ткани, содержащей vasa vasorum – сеть мелких артериальных и венозных сосудов, поддерживающих питание. По мере ветвления артериального дерева интимальный слой становится более широким, проницаемым с большей способностью к пролиферации.
У артерий среднего калибра мышечного типа ширина просвета составляет 2,5-5 мм. Кроме эндотелия, они состоят из очень узкого слоя неорганизованных соединительнотканных клеток, происходящих большей частью из медиа. Внутренняя эластическая мембрана высокоорганизована, имеет поры для прохождения в медиа питательных веществ, состоит из ГМК с ретикулами коллагена и эластических волокон. ГМК обладают свойством сократимости за счет волокон актина и миозина. Функция первых заключается в вазодилатации и вазоконстрикции (в зависимости от типа стимула), синтезе различных типов коллагена и эластина, компонентов экстрацеллюлярного матрикса (протеогликанов), стимуляторов роста и цитокинов. Медиа разделена эластической внешней мембраной, в которой возможно наблюдать нервные окончания.
 Индекс интима-медиа в настоящее время является ключевым показателем развития атеросклеротического процесса и ремоделирования сосудов, измеряемым и мониторируемым при проведении ультразвукового исследования (УЗИ) сосудов.
Индекс интима-медиа в настоящее время является ключевым показателем развития атеросклеротического процесса и ремоделирования сосудов, измеряемым и мониторируемым при проведении ультразвукового исследования (УЗИ) сосудов.
Широкое применение этого метода связано с его относительно низкой стоимостью, простотой, неинвазивностью и безопасностью для больного при достаточно высокой информативности по сравнению с традиционными рентген-ангиографическими методиками. УЗИ магистральных сосудов позволяет оценить их размеры, выявить расширение или сужение их просвета, аневризматические выпячивания, атеросклеротические бляшки, тромбы, а также количественно оценить скорость и характер кровотока (ламинарный или турбулентный). С этой целью используют двухмерную эхокардиографию (В-режим), допплеровское исследование и цветное допплеровское картирование (ЦДК) потоков. Большой информативностью обладают так называемые дуплексные системы, сочетающие двухмерное сканирование сосуда в В-режиме и спектральный анализ допплеровского сигнала.
Датчик устанавливают в типичной области прохождения исследуемого сосуда. Положение пациента при исследовании сонной артерии – горизонтальное с приподнятой грудной клеткой (при помощи подушки), с запрокинутой и повернутой в противоположную сторону от исследователя головой.
Для уточнения топографии сосудов проводят сканирование в плоскости, перпендикулярной анатомическому ходу сосуда. При поперечном сканировании определяют взаиморасположение сосудов, их диаметр, толщину и плотность стенок, состояние периваскулярных тканей. Далее производят поперечное сканирование вдоль исследуемого сегмента сосуда для поиска участков стенозирования. Затем проводят продольное сканирование сосуда, оценивая его ход, диаметр, внутренний контур и плотность стенок, их эластичность, активность пульсации (с использованием М-режима), состояние просвета сосуда. Измеряют толщину комплекса интима-медиа (КИМ) (по дальней стенке). Проводят допплеровское исследование в нескольких участках, перемещая датчик вдоль плоскости сканирования и осматривая по возможности больший участок сосуда.
Оптимальной является следующая схема допплеровского исследования сосудов:
• ЦДК на основании анализа направления или энергии потока для поиска участков с аномальным кровотоком;
• допплеросонография сосуда в импульсном режиме (D), позволяющая оценивать скорость и направление потока в исследуемом объеме крови;
• допплеросонография сосуда в постоянном волновом режиме для исследования высокоскоростных потоков.
Если исследование проводится линейным датчиком, а ось сосуда проходит почти перпендикулярно поверхности, используют функцию наклона допплеровского луча, позволяющую наклонить допплеровский фронт на 15-30 градусов относительно поверхности. Затем совмещают указатель угла с истинным ходом сосуда, получают устойчивый спектр, устанавливают масштаб изображения и положение нулевой линии. При исследовании артерий основной спектр принято располагать выше базовой линии, при исследовании вен – ниже. Ряд авторов рекомендуют для всех сосудов, включая вены, располагать антеградный спектр вверху, ретроградный – внизу. Функция меняет местами положительную и отрицательную полуоси на оси ординат (скоростей) и таким образом изменяет направление спектра на экране в противоположную сторону. Выбранная скорость временной развертки должна быть достаточной для наблюдения двух-трех комплексов на экране.
Расчет скоростных характеристик потоков в режиме импульсной допплерографии возможен при скорости потока не более 1-1,5 м/с. Для получения более точного представления о распределении скоростей необходимо установить контрольный объем не менее 2/3 просвета исследуемого сосуда.
Датчик устанавливают поочередно на каждой стороне шеи в области грудино-ключично-сосцевидной мышцы в проекции общей сонной артерии. При этом визуализируются общие сонные артерии, их бифуркации, внутренние яремные вены. Оценивают контур артерий, их внутренний просвет, измеряют и сравнивают диаметр с обеих сторон на одном уровне. Чтобы отличить внутреннюю сонную артерию (ВСА) от наружной (НСА), используют следующие признаки:
• ВСА имеет больший диаметр, чем НСА;
• начальный отдел ВСА лежит латеральнее НСА;
• НСА на шее дает ветви, может иметь «рассыпной» тип строения; у ВСА на шее ветвей нет.
Для контроля используется проба D. Russel. После получения допплеровского спектра с лоцируемой артерии проводится кратковременная компрессия поверхностной височной артерии (непосредственно перед козелком уха) на стороне исследования. При локации НСА на доплерограмме появятся дополнительные пики, при локации ВСА – форма кривой не изменится.
КИМ измеряется по методике P. Pignoli как расстояние между характерной эхо-зоной, образованной поверхностями просвет-интимы и медиа-адвентиции, в поперечном сечении вручную при помощи электронного штангенциркуля (рис. 2) [4].
Количественные допплеросонографические параметры артериального кровотока:
1. Максимальная систолическая амплитуда линейной скорости кровотока в точке ультразвуковой локации (Smax).
2. Максимальный диастолический пик скорости (Dmax).
3. Индекс спектрального расширения (SB), характеризующий степень турбулентности кровотока в месте локации: SB = (Smax – A)/Smax, где А – скорость максимальной интенсивности кровотока, то есть амплитуда наиболее ярких точек спектра.
4. Индекс пульсации (PI), характеризующий циркуляторное сопротивление в бассейне лоцируемой артерии: PI = (Smax - Dmax)/M, где М – средняя скорость кровотока в точке локации.
5. Индекс циркуляторного сопротивления – IR (индекс Пурселло): IR = (Smax – Dmах)/Smax. Отражает состояние сопротивления кровотоку дистальнее места измерения.
PI, IR важно использовать вместе, так как они отражают разные свойства кровотока в артерии. Использование лишь одного из них без учета другого может быть причиной диагностических ошибок.
Качественная оценка допплеровского спектра
Выделяют ламинарный, турбулентный и смешанный типы потока.
Ламинарный тип – нормальный вариант кровотока в сосудах. Признаком ламинарного кровотока является наличие «спектрального окна» на допплерограмме при оптимальном угле между направлением ультразвукового луча и осью потока.
Турбулентный тип кровотока характерен для мест стеноза или неполных окклюзий сосуда и характеризуется отсутствием «спектрального окна» на допплерограмме. При ЦДК выявляется мозаичность окрашивания в связи с движением частиц в разных направлениях.
Смешанный тип кровотока может в норме определяться в местах физиологических сужений сосуда, бифуркациях артерий. Характеризуется наличием небольших зон турбулентности при ламинарном потоке. При ЦДК выявляется точечная мозаичность потока в области бифуркации или сужения.
Отличие допплерограмм сосудов головы и шеи от допплерограмм конечностей заключается в том, что диастолическая фаза на допплерограммах артерий брахиоцефальной системы никогда не бывает ниже 0 (не опускается ниже base line). Это связано с особенностями кровоснабжения головного мозга. При этом на допплерограммах сосудов системы ВСА диастолическая фаза выше, а системы НСА – ниже.
С методологической точки зрения необходимо подчеркнуть, что измерения, ограничивающиеся КИМ общей сонной артерии, в основном отражают гипертрофию медиа. Поэтому для оценки атеросклеротических изменений необходимо также анализировать область бифуркации (в участке, в наибольшей степени подверженном отрицательному гемодинамическому воздействию повышенного артериального давления [АД] и развитию атеросклероза) и определять изменение числа бляшек.
Ремоделирование с точки зрения патофизиологии означает обретение новой функции биологической структурой [2, 5].
Суть ремоделирования заключается в способности органа изменять структуру и геометрию в ответ на долговременное воздействие патологических стимулов. Значимость толщины КИМ как фактора риска развития сосудистых катастроф в настоящее время достаточно не определена [6].
Ремоделирование сосудов начинается обычно как адаптивный процесс в ответ на изменение условий гемодинамики или активности тканевых и циркулирующих гуморальных факторов. Длительно существующая адаптация сменяется нарушением структуры сосудов в ответ на прямое повреждение, в том числе токсичными веществами и метаболитами, на воздействие атерогенных факторов или изменение гемодинамической нагрузки. В последующем структурные повреждения сосудов проявляются нарушениями их функций (проводящей и/или демпфирующей), что последовательно ведет к расстройству кровообращения органов и нарушению их функций [2, 5].
Различают концентрическое ремоделирование, при котором уменьшается просвет сосуда, и эксцентрическое, при котором просвет увеличивается. В отношении сосудистой массы выделяют гипотрофический, эутрофический и гипертрофический типы ремоделирования в зависимости от снижения, отсутствия изменений или увеличения клеточных компонентов (рис. 3) [7].
Не все формы ремоделирования являются отображением патологического процесса и не все формы связаны с ухудшением тока крови в кровоснабжаемых отделах. Происходящие структурные и даже количественные изменения на самом деле показывают долгий процесс адаптации сосудистой системы к изменениям сердечного выброса. Результат хронической перегрузки давлением участков артериальных сосудов (в частности, на уровне периферических сосудов) проявляется значительными изменениями геометрии и архитектоники сосудов.
Наиболее значимые патофизиологические аспекты изменений затрагивают мелкие сосуды.
Согласно закону Пуайзеля, детерминантами артериального сопротивления являются вязкость крови, длина и калибр сосуда. Но так как длина сосуда и вязкость крови являются относительно постоянными величинами, размер сосуда может изменяться в результате резких изменений тонуса или вследствие длительного процесса ремоделирования. Свойства стенки сосуда зависят от двух характеристик:
• растяжимости (прямо пропорциональной давлению и радиусу и обратно пропорциональной толщине стенки);
• напряжению сдвига (комплекс сил, действующих на сосудистую стенку в результате тока крови).
Изменения радиуса и толщины стенки поддерживают эти две величины в относительно постоянном состоянии (рис. 4) [8, 9].
При повышенном токе крови радиус сосуда увеличивается для снижения напряжения сосудистой стенки. При высоком внутрисосудистом давлении компенсаторно увеличивается толщина сосуда и уменьшается диаметр. С одной стороны, увеличение толщины сосудистой стенки снижает растяжимость и сохраняет поток крови. С другой стороны, эффект прогрессирующего уменьшения внутреннего диаметра заключается в снижении доставки крови к тканям, что приводит к повреждению органа. Эти эффекты более выражены на уровне почек, так как они приводят к дальнейшему повышению напряжения артериол и самоподдержанию прогрессирования заболевания.
Концентрическое сосудистое ремоделирование обычно развивается при повышенном внутрисосудистом давлении или снижении тока крови, в то время как эксцентрическое ремоделирование развивается при повышении тока крови [10].
Гистологическими характеристиками эксцентрического ремоделирования являются: истончение стенки сосуда, снижение гладкомышечного компонента медиа, уменьшение экстрацеллюлярного матрикса и снижение отношения толщины стенки сосуда и внутреннего диаметра [11]. При этом варианте ремоделирования сосудов выявляют дегенеративные изменения медиа с повышением в ней уровня коллагена, фиброэластическое утолщение интимы, фрагментацию эластической мембраны с вторичным фиброзом и кальцинозом медиа и изменения экстрацеллюлярного матрикса [12].
У больных с АГ часто выявляются структурные изменения сосуда, преимущественно по гипертрофическому типу [13]. Происходит увеличение массы кровеносного сосуда за счет утолщения его мышечного слоя (медиа) и/или субэндотелиальных слоев интимы вследствие увеличения количества ГМК (гиперплазия) в сосудах крупного и среднего калибра или клеточной массы (гипертрофия) в резистивных сосудах, а также сочетания этих процессов [2, 5].
Увеличение толщины КИМ, как правило, процесс сопряженный и связанный с активацией, пролиферацией и миграцией ГМК, а также с перестройкой клеточных элементов и экстрацеллюлярного матрикса сосудистой стенки. Его результатом является увеличение толщины сосудистой стенки, при этом эластические свойства артерий снижаются, развивается их жесткость, ригидность.
Отношение толщины стенки к просвету сосуда увеличивается, происходит сужение сосуда, ведущее к развитию гемодинамически значимых препятствий кровотоку.
Сочетание диффузной дилатации артерий гипертрофии больших проводящих артерий и жесткости артериальной стенки характеризуется как артериосклероз [14].
Чаще всего в условиях определенной патологии ремоделирование сосудов определяет доминирующий причинный фактор: длительная АГ, атеросклероз, сердечная недостаточность.
Поражение сосудов при АГ включает дисфункцию эндотелия, утолщение КИМ крупных артерий, прежде всего сонных, и впоследствии развитие и прогрессирование атеросклероза.
В работах B. Folkow впервые показана роль структурных изменений сосудистой стенки, преимущественно артериол и капилляров, в повышении периферического сопротивления при АГ, причиной которых является ремоделирование [15-17].
J.D. Ollerenshaw et al. создали экспериментальную модель, позволившую доказать значимость механического влияния гипертензии на стенку сосуда [18]. Они использовали искусственно созданную коарктацию аорты, чтобы отдельно оценить вклад механических и гуморальных факторов в развитие гипертрофии сосудов. В этой модели АД выше сужения было значительно повышенным, а ниже места сужения – относительно нормальным. И хотя аорта ниже места сужения была подвержена влиянию тех же гуморальных факторов, что и участок аорты выше сужения, развитие гипертрофии стенки сосуда только в области высокого давления свидетельствует, что именно механический стимул является одним из пусковых механизмов в развитии гипертрофии сосуда. Указанная работа была одной из первых, подтвердивших значимость механических факторов в процессе гипертрофии сосудистой стенки.
Толщина КИМ в сонных артериях – один из независимых факторов риска развития транзиторных ишемических атак и инсульта [19, 20]. Чем она больше, тем выше вероятность развития инсульта.
Подтверждение компенсаторной роли утолщения КИМ для обеспечения адекватности кровотока и зависимости толщины просвета сонной артерии от толщины КИМ получены в ходе исследования, проведенного R. Kazmierski et al. [21]. После проведения УЗИ общих сонных артерий у 233 пациентов ученые обнаружили, что увеличение индекса интима-медиа общей сонной артерии до 1,2 мм сопровождается пропорциональным увеличением просвета сосуда. Дальнейший рост индекса (> 1,3 мм) ведет к обратному процессу – концентрическому сужению просвета артерии.
Дуплексное сканирование сонных артерий, проведенное в ходе исследования ELSA (European Lacidipine Study on Atherosclerosis), выявило нормальное значение индекса интима-медиа у 1% обследованных, в 17% случаев было обнаружено утолщение КИМ, в 82% – наличие атеросклеротических бляшек.
Изменение структуры сосудистой стенки по гипертрофическому типу может приводить к развитию атеросклероза с последующим исходом в ишемическую болезнь сердца и/или ишемический инсульт (атеротромботическй тип). Истончение стенки сосуда в результате изменения структуры базальной мембраны и коллагенового матрикса ведет к появлению микроаневризм и может служить причиной развития геморрагического инсульта [22]. В настоящее время данные о корреляционной связи между значением индекса интима-медиа и риском развития геморрагического инсульта недостаточны, требуется проведение дополнительных исследований [23]. Однако имеются работы, демонстрирующие связь между типом ишемического инсульта, его локализацией, размером очага ишемического повреждения и индексом интима-
медиа [24-26].
Ультразвуковые признаки утолщения стенки артерий (определяемые с помощью УЗИ сонных артерий
в В-режиме) вошли в Европейские рекомендации по профилактике, диагностике и лечению АГ как одна из характеристик поражения органов-мишеней [27].
В качестве нормы экспертами Европейского общества по АГ и Европейского общества кардиологов в 2007 г. выбраны значения толщины стенки < 0,9 мм, утолщение КИМ 0,9-1,3 мм, а критерием бляшки обозначен КИМ, равный 1,3 мм. За бляшку принимается фокальное утолщение стенки артерии со стороны просвета высотой > 1,3 мм. При их анализе учитывается размер, локализация, форма, структура, эхогенность. Размер бляшек определяется вручную при помощи электронного штангенциркуля [27].
Установлена тесная взаимосвязь увеличения КИМ с риском развития кардиальных и цереброваскулярных осложнений, особенно при наличии АГ. Так, по данным M. Bots et al. (Роттердамское исследование) [28], утолщение КИМ уже в диапазоне нормальных значений (0,75-0,91 мм) сопровождается увеличением относительного риска развития первого инсульта в 4,8 раза. В исследовании ARIC был установлен рост частоты развития ишемической болезни сердца в 4,3 раза у мужчин и 19,5 раза у женщин при увеличении КИМ в диапазоне 0,6-1 мм [29]. Тесная взаимосвязь утолщения стенки сонной артерии и риска развития кардиальных и цереброваскулярных осложнений [28, 29] ассоциируется с высокой частотой встречаемости повышенных значений КИМ у бессимптомных пациентов с высоким риском сердечно-сосудистых осложнений. A. Favre et al. [30] показали, что у 2 142 пациентов без признаков атеросклеротического заболевания, но с двумя факторами риска, такими как семейный анамнез сердечно-сосудистых заболеваний, АГ, дислипидемия, сахарный диабет, избыточная масса тела, курение, низкая физическая активность увеличение КИМ и атеросклеротические бляшки выявлены в 59,3% случаев. Иными словами, высокая прогностическая значимость увеличения КИМ (часто отмечаемая у бессимптомных больных) должна определить высокую потребность в выполнении УЗИ сонных артерий.
В современных рекомендациях УЗИ брахиоцефальных и почечных артерий входит в число только дополнительных исследований, а не тех, выполнение которых обязательно для каждого пациента с АГ. Более того, при стратификации риска выявление более трех факторов риска (как правило, у больных с АГ выявляется несколько факторов) уже при высоком нормальном АД позволяет отнести пациента в группу высокого риска.
Ремоделирование сосудистой стенки является сложным полиэтиологическим процессом, влияя на отдельные звенья которого возможно предотвращение многих осложнений АГ и атеросклероза, снижение риска развития цереброваскулярных заболеваний, занимающих лидирующую позицию среди причин смертности населения. Поэтому определение КИМ имеет диагностическое значение для оценки особенностей ремоделирования и атеросклеротического поражения сосудов и практическое значение как предиктора сосудистых катастроф у пациентов с АГ и атеросклерозом.
Литература
1. Levy B.I., Safar M.E. Remodelling of the vascular system in response to hypertension and drug therapy // Clin Exp Pharmacol Physiol Suppl. – 1992. – Vol. 19. – P. 33-37.
2. Dzau V.J., Gibbons G.Н. Vascular remodeling: mechanisms and implications // J Cardiovasc Pharmacol. – 1993. – Vol. 21 (suppl. I). – S1-S5.
3. Castro S. Рatophysiology of arterial disease // One way S.r.l. – Italy. – 2007. – 48 p.
4. Pignoli P., Tremoli E., Poli A., Oreste P., Paoletti R. Intimal plus medial thickness of thearterial wall: a direct measurement with ultrasoubd imaging // Circulation. – 1986. – Vol. 74. – P. 1399-1406.
5. Gibbons Н.Н., Dzau V.J. The emerging concept of vascular remodeling // N Engl J Med. – 1994. – Vol. 330. – P. 1431-1438.
6. Touboul P.J., Hennerici M.G., Meairs S. et al. Mannheim intima-media thickness Consensus // 13th European Stroke Conference, Mannheim Germany. – Cerebrovasc Dis. – 2004. – Vol. 18 (4). – P. 346-349.
7. Mulvany M.J. Vascular remodelling of resistance vessels: can we define this? // Cardiovascular Research. – 1999. – Vol. 41. – P. 9-13.
8. Iton H., Kazuwa N. Vascular stress response and endothelial vasoactive factors for vascular remodelling // Diabetes Res Clin Pract. – 1999. – Vol. 45 (2-3). – P. 83-88.
9. Mayet J., Hughes A. Cardiac and vascular pathophysiology in hypertension // Heart. – 2003. – Vol. 89 (9). – P. 1104-1109.
10. Ward M.R., Pasterkamp G., Yeung A.C., Borst C. Arterial remodelling. Mechanism and implications // Circulation. – 2000. – Vol. 102. – P. 1186-1191.
11. Intengan H.D., Schiffrin E.L. Structure and mechanical properties of resistance arteries in hypertension: role of adhesion molecules and extracellular matrix determinants // Hypertension. – 2000. – Vol. 36. – P. 312-318.
12. Avolio A., Cben S.G., Wang R.P. et al. Effects of aging on changing arterial compliance and left ventricular load in a northern Chinese urban community // Circulation. – 1983. – Vol. 68. – P. 50- 58.
13. Walsh K., Smith R.C., Kim H.S. Vascular cell apoptоsis in remodeling, restenosis, and plaque rupture // Circ Res. – 2000. – Vol. 87(3). – P. 184-188.
14. O'Rourke М. F. Mechanical principles in arterial disease // Hypertension. – 1995. – Vol. 26. – P. 2-9.
15. Boudier S.H. Arteriolar and capillary remodelling in hypertension. // Drugs. – 1999. – Vol. 59. – P. 37-40.
16. Folkow B. Physiological aspects of primary hypertension // Physiol Rev. – 1982. – Vol. 62. – P. 347-504.
17. Folkow B. The «structural factor» in hypertension with special emphasis on the hypertrophic adaptation of the systemic resistance vessels in: Hypertension: pathophysiology, diagnosis and management. Raven Press, Ltd. – 1990. – P. 565-581.
18. Ollerenshaw J.D., Heagerty A.M., West P.W., Swales J.D. The effects of coarctation hypertension upon vascular inositol phospholipids hydrolysis in Wistar rats // J Hypertension. – 1988. – Vol. 6. – P. 733-738.
19. Dempsey R.J., Diana A.L., Moore R.W. Thickness of carotid artery atherosclerotic plaque and ischemic risk // Neurosurgery. – 1990. – Vol. 27 (3). – P. 343-348.
20. Goldstein L.B., Adams R., Becker K. et al. Primary prevention of ischemic stroke. A statement for healthcare professionals from the stroke council of the American heart Association. – Stroke. – 2001. – Vol. 32. – P. 280.
21. Kazmierski R., Watala C., Lukasik M., Kozubski W. Common carotid artery remodeling studied by sonomorphological criteria // J Neuroimaging. – 2004. – Vol. 14. – P. 258-264.
Значение лодыжечно-плечевого индекса давления в скрининговых исследованиях в центрах здоровья
 Дисперсионное картирование ЭКГ: - высокоэффективный метод диагностики и контроля ИБС на доклинической стадии: КардиоВизор-06с на странице каталога
Дисперсионное картирование ЭКГ: - высокоэффективный метод диагностики и контроля ИБС на доклинической стадии: КардиоВизор-06с на странице каталога
 ABI-System 100- аппарат для ангиологического скрининга с автоматической системой измерения артериального давления на конечностях: расчет лодыжечно-плечевого индекса, скорости пульсовой волны, детекцией нарушения ритма сердца
ABI-System 100- аппарат для ангиологического скрининга с автоматической системой измерения артериального давления на конечностях: расчет лодыжечно-плечевого индекса, скорости пульсовой волны, детекцией нарушения ритма сердца
Раннее распознавание поражения периферических артерий– быстро, точно, без допплера. Аппарат boso ABI-System 100 – важное достижение в области диагностики и профилактической медицины